Truvada
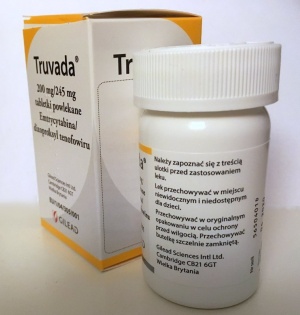


Truvada, lek stosowany w zapobieganiu i leczeniu nosicielstwa wirusa HIV-1.[1] Jest to kombinacji leków przeciwretrowirusowych: dizoproksylu tenofowiru i emtrycytabiny w formie tabletek przyjmowanych doustnie. W lecznictwie stosuje się go samodzielnie lub w połączeniu z innymi lekami przeciwretrowirusowymi.
Obecnie wyróżnia się dwa typy wirusa HIV: HIV-1 i HIV-2. Lek Truvada jest przeznaczony do zapobiegania i leczenia nosicielstwa wyłącznie wirusa typu HIV-1. Wirus HIV-2 występuje głównie na terenie Afryki Zachodniej i niesie mniejsze ryzyko zakażenia, dlatego w przeciwieństwie do wirusa HIV-1, który ma zasięg globalny, zakażenie wirusem HIV-2 poza Afryką Zachodnią jest mało prawdopodobne.[2]
Światowa Organizacja Zdrowia (WHO) zaleca stosowanie tabletek Truvada osobom podejmującym ryzykowne zachowania seksualne jako profilaktykę przedekspozycyjną (PrEP).[3] Tak jak inne leki antyretrowirusowe Truvada nie eliminuje wirusa HIV ale blokuje jego namnażanie.
Częste działania niepożądane obejmują bóle głowy, uczucie zmęczenia, problemy ze snem, bóle brzucha, utratę wagi i wysypkę. Poważne działania niepożądane mogą obejmować wysoki poziom mleczanu we krwi i powiększenie wątroby. Nie wykazano by stosowanie w czasie ciąży było szkodliwe dla dziecka.[4]
Truvada została zatwierdzona do użytku medycznego w Stanach Zjednoczonych w 2004 roku. Znajduje się na liście najważniejszych leków Światowej Organizacji Zdrowia. Jest również wpisana do Rejestru Produktów Leczniczych Dopuszczonych do Obrotu na terytorium Rzeczypospolitej Polskiej i Wspólnotowego Rejestru Produktów Leczniczych.[5]
Truvada – dane farmaceutyczne
Tabletka powlekana leku Truvada zawiera 200 mg emtrycytabiny oraz 245 mg tenofowiru dizoproksylu oraz substancje pomocnicze, m.in. 96 mg laktozy jednowodnej. W sprzedaży dostępne są opakowania z 1 lub 3 butelkami zawierającymi po 30 tabletek. Okres ważności Truvady od momentu wyprodukowania wynosi 4 lata.[1]
Zastosowania medyczne leku Truvada
Truvada w profilaktyce zakażeń HIV u osób dorosłych
W Stanach Zjednoczonych lek Truvada został zatwierdzony do profilaktyki przedekspozycyjnej (PrEP) zakażeń wirusem HIV. Amerykańska Agencja Żywności i Leków (FDA) zatwierdziła go do stosowania prewencyjnego 16 lipca 2012 r.[6]
FDA zaleca rozważania profilaktyczne przed narażeniem (PrEP) dla następujących grupach:
- Homoseksualni lub biseksualni mężczyźni, którzy albo mieli seks analny bez prezerwatywy albo zdiagnozowano u nich chorobę przenoszoną drogą płciową w ciągu ostatnich 6 miesięcy
- Heteroseksualni mężczyźni lub kobiety, którzy nie używają regularnie prezerwatyw podczas stosunku seksualnego z partnerami o nieznanym statusie nosicielstwa HIV, którzy są poważnie zagrożeni
- Osoby wstrzykujące sobie narkotyki w ostatnim miesiącu niesterylnym sprzętem
- Heteroseksualne i homoseksualne pary, w których jedna osoba jest zakażona HIV, a druga nie
Również WHO zaleca przyjmowanie leku Truvada mężczyznom uprawiającym seks z mężczyznami.[7]
Dawkowanie leku Truvada w profilaktyce przedekspozycyjnej
Według zaleceń producenta Truvady dla osób dorosłych o wadze powyżej 35 kg i zdrowych nerkach dawkowanie powinno wynosić 1 tabletka co 24 godziny, najlepiej podczas posiłku, jeżeli lekarz nie zaleci inaczej. Producent jednak nie precyzuje ile dni przed lub po ryzykownym kontakcie powinno się stosować Truvadę.[1] Jedno z badań wskazuje, że u 84% badanych, ochronny poziom leku został osiągnięty po 4 dawkach Truvady zmniejszając ryzyko zakażenia HIV-1 o 98%. Przy 7 dawkach już 90% badanych osiągało poziom ochrony przed zakażeniem na poziomie 99%. Z kolei w badaniu „IPERGAY” oszacowano, że do zmniejszenia ryzyka zakażenia wirusem HIV-1 o 97%, wystarczą dwie dawki Truvady do 24 godzin przed kontaktem z osobą zakażoną i dwie kolejne dawki po kontakcie. Wskazuje to, że schemat stosowania 2 tabletek przed stosunkiem z osobą zakażoną i dwie tabletki po stosunku zapewniają wysoką ochronę przed wirusem HIV-1 w kontaktach drogą analną. W przypadku kontaktów pochwowych ze względu na istnienie możliwości spadku terapeutycznego stężenia leku w tkankach pochwy, nie została jednoznacznie określona minimalna ilość dawek.[8]
W przypadku pominięcia dawki Truvady jeżeli minęło do 12 godzin należy jak najszybciej przyjąć pominiętą dawkę i powrócić do normalnych godzin przyjmowania leku. W przypadku gdy minęło więcej niż 12 godzin nie należy przyjmować pominiętej dawki i zażyć właściwą dawkę o zwykłej porze.[1]
Skuteczność leku Truvada w profilaktyce przedekspozycyjnej
Największym jak dotąd badaniem nad skutecznością leku Truvada było badanie iPrEx sfinansowane przez Narodowy Instytut Zdrowia (National Institutes of Health) i Fundację Billa i Melindy Gates. Objęły 2499 osób, którym losowo przydzielono lek Truvada lub placebo. Uzyskany wynik to skuteczność 44% w oparciu o dane na temat wydanych tabletek. Część pacjentów przyjmowała lek nieregularnie. Skuteczność leku była wyższa w podgrupie, która wedle własnych deklaracji przyjęła ponad 90% otrzymanych tabletek. Dane skorygowane na podstawie stwierdzonej obecności leku w krwi wskazują na skuteczność na poziomie 92%.[9]
Podobne badanie przeprowadzone na 1219 osób w Botswanie wskazuje na 62,2% w oparciu wyłącznie o przynależność do grup. Nie podano wartości skorygowanych w oparciu o poziom leku w krwi. [10]
Kolejne badanie sfinansowane przez Fundację Billa i Melindy Gates koncentrowało się na parach heteroseksualnych i prócz potwierdzenia skuteczności leku Truvada wykazało, że choć skuteczność jednego składnika leku – tenofowiru była mniejsza od mieszaniny to jednak różnica ta nie była statystycznie istotna.[11]
Podobne wyniki (również w oparciu o przynależność do grup, a nie poziom leku we krwi) uzyskano w badaniu na 2413 osobach w Bangkoku.[12]
Truvada a laktacja – profilaktyka HIV u niemowląt
Jedną z możliwych form przeniesienia wirusa HIV jest karmienie piersią przez matkę będącą nosicielką wirusa HIV. Wykazano, że w czasie ciąży i laktacji lek Truvada jest uwalniany do mleka kobiecego przez co może stanowić element profilaktyki zakażeń HIV tą drogą.[13] Jednak ze względu na duże ryzyko przeniesienia wirusa HIV z matki na dziecko oraz brak wystarczających danych dotyczących wpływu Truvady na organizm noworodków i dzieci, Truvada nie powinna być stosowana podczas karmienia piersią.[1]
Truvada w leczeniu HIV
Stosowanie leku Truvada w leczeniu HIV odbywa się pod kontrolą lekarza, który dobiera leki tak by utrzymać poziom limfocytów CD4 na możliwie wysokim, a wiremię na możliwie niskim poziomie.
Lek Truvada a przenoszenie HIV
Nie dowiedziono, że leki przeciwretrowirusowe takie jak np. Truvada, zapobiegały przenoszeniu HIV na inne osoby, dlatego nawet podczas stosowania Truvady należy zachowywać środki ostrożności podczas ryzykownych kontaktów.[1]
Lek Truvada a wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Nie przeprowadzono badań nad wpływem Truvady na zdolność prowadzenia pojazdów i obsługiwania maszyn. Jednak u osób leczonych zarówno emtrycytabiną, jak i fumaranem tenofowiru dizoproksylu zgłaszano przypadki zawrotów głowy.[1]
Dostępne formy leku Truvada
Truvada w formie dopuszczonej do handlu to tabletka przyjmowana doustnie. Istnieją jednak badania nad stosowaniem tego leku w formie żelu dopochwowego.[14]
Zamienniki leku Truvada
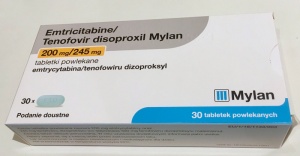
Europejska ochrona patentowa leku Truvada (dla Gilead Sciences Inc.) wygasła w 2018 roku co umożliwiło wszystkim producentom oferowanie jego generycznych zamienników czyli leków o takim samym składzie (tej samej ilości substancji aktywnej), tej samej postaci, tej samej dostępności biologicznej i takim samym działaniu farmakologicznym. Ceny leków generycznych są znacząco niższe w stosunku do leków oryginalnych.
Efekty uboczne przyjmowania leku Truvada
Truvada jest ogólnie dobrze tolerowanym lekiem. Niektóre z efektów ubocznych obejmują:[15]
- Rzadko: kwasica mleczanowa, zaburzenia czynności wątroby, nasilenie zakażenia wirusem zapalenia wątroby typu B.
- Często: bóle głowy, bóle brzucha i zmniejszenie masy ciała, nudności, biegunka, zmniejszenie gęstości kości
U osób stosujących lek Truvada zaobserwowano redystrybucję tłuszczu i kumulację, w tym zmniejszenie tkanki tłuszczowej twarzy, kończyn i pośladków oraz zwiększenie trzewnej tkanki tłuszczowej brzucha i nagromadzenie w górnej części pleców. W przypadku stosowania jako profilaktyka przedekspozycyjna (PrEP) efekt ten może nie występować.
Truvada stosowana w profilaktyce nie powoduje zwiększenia ilości tkanki tłuszczowej.[16]
Interakcje Truvada i innych leków
Stwierdzono występowanie interakcji składników leku Truvada z następującymi lekami:
- didanozyna,
- atazanawir,
- lopinawir/rytonawir.
Inne niepożądane reakcje z lekiem Truvada obejmują:
- adefowir,
- eteksylan dabigatranu,
- lamiwudyna,
- winkrystyna.
Nie należy przyjmować dużych dawek niesteroidowych leków przeciwzapalnych NLPZ u pacjentów przyjmujących lek Truvada z powodu możliwego „nowego lub nasilającego się upośledzenia czynności nerek”.
Zalety i wady leku Truvada w porównaniu z innymi formami profilaktyki
W publicystyce na temat leku Truvada podkreśla się jego zalety w porównaniu do stosowania prezerwatyw.
- Zalety[17]
- Wyższa skuteczność (ponad 90% skuteczność leku Truvada w porównaniu z 86% dla prezerwatyw)
- Nie wymaga przerywania gry wstępnej.
- Nie wymaga sprawności manualnej.
- Nie ma problemu niedopasowania do rozmiaru członka.
- Nie wiążę się z utrudnieniami w przypadku podejmowania współżycia przy braku oświetlenia.
- Nie wymaga zmian w przypadku współżycia z wieloma partnerami.
- O stosowaniu prezerwatyw łatwo zapomnieć w sytuacji odurzenia substancjami psychoaktywnymi, a o leku Truvada wystarczy pamiętać raz w ciagu doby.
- Wady
- Możliwe działania niepożądane.
- Truvada działa tylko względem jednego wirusa podczas gdy inne środki mogą chronić przed wieloma chorobami przenoszonymi drogą płciową.
- Ryzyko pojawienia się zmutowanych form wirusa odpornych na leki antyretrowirusowe.[18]
Stosowanie leku Truvada nie wyklucza jednoczesnego użycia innych środków ochrony takich jak prezerwatywa, która zmniejsza ryzyko przeniesienia innych chorób, a także w przypadku par heteroseksualnych ryzyko niechcianej ciąży.
Truvada w społeczeństwie i kulturze
Dostępność i cena leku Truvada w Polsce
Lekarze interniści zarówno publicznej jak i prywatnej służby zdrowia są uprawnieni do wystawiania recept na lek Truvada.
Cena Truvady
Lek Truvada nie znajduje się obecnie na liście leków refundowanych Narodowego Funduszu Zdrowia (NFZ). Ze względu na wysoką cenę Truvady, sięgającą ok. 4000 zł (ok. 1000 dolarów amerykańskich[17]) za miesięczną kurację (opakowanie 30 tabletek), nie jest on stale obecny w aptekach i konieczne jest jego sprowadzanie.
Reakcje społeczne związane z lekiem Truvada
W języku angielskim pojawiło się określenie „Truvada-whore” (ang. „K... na Truvadzie”), piętnujące osoby stosujące profilaktykę przedekspozycyjną HIV i wyrażające dezaprobatę ze względu na prowadzone życie seksualne. Osoby stosujące to określenie, kierują się błędnym przeświadczeniem co do braku stosowania innych zabezpieczeń i insynuują możliwość wzrostu liczby zakażeń innymi chorobami przenoszonymi drogą kontaktów seksualnych.[19][17]
Publicysta Jakub Janiszewski, autor książki „Kto w Polsce ma HIV?”, w jednym ze swych felietonów porównuje histeryczne reakcje snujące wizje bezgranicznego promiskuityzmu do analogicznej krytyki jaka towarzyszyła w latach 60. XX w. pojawieniu się hormonalnych środków antykoncepcyjnych. Stawiano wtedy na łamach prasy pytania „Czy pigułka jest licencją na promiskuityzm?”, „Czy udostępnienie jej kobietom w wieku rozrodczym doprowadzi do anarchii seksualnej?”[19]
Wyniki badań naukowych przeczą domniemywanemu wzrostowi ryzykownych zachowań seksualnych w związku z przyjmowaniem profilaktyki przedekspozycyjnej.[20]
Przypisy
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 Aneks 1: Charakterystyka produktu leczniczego (pol.). ec.europa.eu, 2013-07-01. [dostęp 2018-03-12].
- ↑ S. Ibe, Y. Yokomaku, T. Shiino, R. Tanaka i inni. HIV-2 CRF01_AB: first circulating recombinant form of HIV-2. J. Acquir. Immune Defic. Syndr., 54 (3), s. 241–247 (lipiec 2010), PMID 20502347 (ang.).
- ↑ WHO Model Formulary 2008. World Health Organization, 2009, s. 160. ISBN 9789241547659. (ang.)
- ↑ Emtricitabine / tenofovir Use During Pregnancy (ang.). drugs.com. [dostęp 2018-03-10].
- ↑ Truvada (pol.). pub.rejestrymedyczne.csioz.gov.pl. [dostęp 2018-03-10].
- ↑ FDA approves first pill to help prevent HIV (ang.). seattletimes.nwsource.com, 16 lipca 2012. [dostęp 2018-03-10].
- ↑ Michał Rolecki: Zalecenie WHO: geje mają brać leki na HIV. Nawet jak są zdrowi (pol.). wyborcza.pl, 2014-07-13. [dostęp 2018-03-10].
- ↑ Emily Land: Evidence that “on-demand” PrEP taken before and after sex can prevent HIV (ang.). betablog.org, 2016-09-08. [dostęp 2018-03-12].
- ↑ R.M. Grant, J.R. Lama, P.L. Anderson, V. McMahan i inni. Preexposure chemoprophylaxis for HIV prevention in men who have sex with men. N. Engl. J. Med., 363 (27), s. 2587–2599 (grudzień 2010), PMID 21091279 (ang.).
- ↑ M.C. Thigpen, P.M. Kebaabetswe, L.A. Paxton, D.K. Smith i inni. Antiretroviral preexposure prophylaxis for heterosexual HIV transmission in Botswana. N. Engl. J. Med., 367 (5), s. 423–434 (sierpień 2012), PMID 22784038 (ang.).
- ↑ J.M. Baeten, D. Donnell, P. Ndase, N.R. Mugo i inni. Antiretroviral prophylaxis for HIV prevention in heterosexual men and women.. N Engl J Med, 367 (5), s. 399–410 (sierpień 2012), PMID 22784037 (ang.).
- ↑ K. Choopanya, M. Martin, P. Suntharasamai, U. Sangkum i inni. Antiretroviral prophylaxis for HIV infection in injecting drug users in Bangkok, Thailand (the Bangkok Tenofovir Study): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet, 381 (9883), s. 2083–2090 (czerwiec 2013), PMID 23769234 (ang.).
- ↑ Recommendations for use of antiretroviral drugs in pregnant HIV-1-infected women for maternal health and interventions to reduce perinatal HIV transmission in the United States (ang.). aidsinfo.nih.gov.
- ↑ A. Olczak, E. Grabczewska. Profilaktyka przedekspozycyjna (PrEP) zakażenia HIV. Przegląd Epidemiologiczny, 66 (1), s. 79–82 (2012), PMID 22708303 (pol.).
- ↑ US Truvada (emtricitabine/tenofovir disoproxil fumarate) label (ang.). accessdata.fda.gov.
- ↑ Truvada as HIV PrEP not associated with net fat increase (ang.). [dostęp 2018-03-10].
- ↑ 17,0 17,1 17,2 Jakub Janiszewski: Janiszewski: Kondomy od Prady (pol.). krytykapolityczna.pl, 2014-02-01. [dostęp 2018-03-10].
- ↑ Halina Pilonis: Czy lek na AIDS naprawdę istnieje? (pol.). medonet.pl, 2017-05-05. [dostęp 2018-03-10].
- ↑ 19,0 19,1 Jakub Janiszewski: Ryzykowny seks? To nie my (pol.). wyborcza.pl, 2014-09-24. [dostęp 2018-03-10].
- ↑ J.N. Martin, M.E. Roland, T.B. Neilands, M.R. Krone i inni. Use of postexposure prophylaxis against HIV infection following sexual exposure does not lead to increases in high-risk behavior. AIDS, 18 (5), s. 787–792 (marzec 2004), PMID 15075514 (ang.).